PARTIKEL SUBATOM DAN TEORI ATOM
Bismillahirrahmaanirrhiim
Benda-benda di sekitarmu merupakan susunan dari suatu partikel yang sangat kecil. Partikel tersebut dinamakan atom. Jadi atom merupakan unit terkecil dari suatu benda. Walaupun atom sebagai unit terkecil, tetapi atom terdiri dari bagian yang lebih kecil lagi yang disebut partikel subatom.
Atom terdiri dari 2 komponen utama yaitu bagian inti dan bagian kulit. Inti atom terdiri dari proton dan neutron, sedangkan kulit atom terdapat elektron.
Partikel atom dan subatomnya tersebut tidak dapat dilihat dengan mata karena ukurannya yang sangat kecil. Bahkan lebih kecil dari ukuran bakteri dan virus. Tetapi peristiwa dari aktivitas elektron dapat dilihat dan dirasakan manfaatnya.
Teori-teori tentang atom sudah dikemukakam oleh para ilmuwan sejak dulu. Teori yang satu akan runtuh atau ditolak ketika ada data atau fakta baru yang ditemukan tentang atom sehingga melahirkan teori atom yang baru.
Apa saja bagian-bagian atom ? Apa saja peristiwa yang merupakan hasil dari aktivitas elektron yang merupakan bagian atom? dan bagaimana teori mengenai atom? Baca penjelasan di bawah ini dengan santai ya.. Artikel ini dapat kamu akses di ipamts.com.
Partikel Subatom
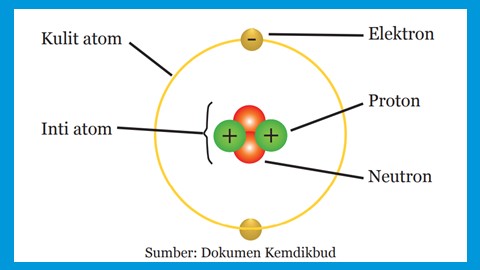 |
| Struktur partikel subatom |
Atom merupakan satuan dasar dari suatu materi. Suatu atom disusun oleh partikel-partikel penyusun atom atau partikel subatom. Berdasarkan gambar di atas, partikel subatom terdiri dari proton, neutron dan elektron. Sekarang, berikut ini penjelasan mengenai proton, neutron dan elektron.
Proton
Proton adalah bagian atom yang bermuatan positif. Proton terletak di dalam inti atom. Simbol proton biasa ditulis p. Jumlah proton dalam setiap unsur adalah unik, sehingga dijadikan sebagai dasar nomor atom. Banyaknya proton dalam inti atom akan menentukan sifat kimia suatu atom.
Baca juga : Listrik pada Sel Saraf - IPA MTs
Pada atom netral, jumlah proton akan sama dengan jumlah elektron. Jika jumlah proton dan elektron tidak sama dalam suatu atom, maka atom tersebut mengalami ionisasi sehingga atom tersebut memiliki muatan atau menjadi ion.
Neutron
Neutron merupakan partikel subatomik yang tidak bermuatan. Neutron terletak di dalam inti atom bersama dengan proton. Simbol neutron biasa ditulis dengan n. Jumlah proton dan neutran dalam inti atom menentukan nomor massa dari atom tersebut. Setiap inti atom umumnya memiliki proton dan neutron kecuali hidrogen yang inti atomnya hanya terdiri dari satu proton.
Pembuktian adanya partikel neutron dalam inti atom dilakukan oleh seorang ilmuwan bernama James Chadwick pada tahun 1932. Penelitian dilakukan dengan menembakkan sinar alfa ke logam berilium yang menimbulkan pelepasan partikel tidak bermuatan dan disebut neutron.
Elektron
Elektron adalah partikel subatom yang bermuatan negatif. Simbol elektron ditulis dengan e. Elektron terdapat di kulit-kulit atom yang merupakan lintasan atau orbit dari pergerakan elektron. Elektron bergerak mengelilingi inti atom dengan kecepatan mendekati kecepatan cahaya dan membentuk awan elektron yang disebut orbital. Elektron tersebut terikat oleh inti atom oleh gaya elektromagnetik.
Elektron memiliki massa yang sangat kecil dibandingkan dengan massa proton dan neutron. Elektron yang terletak pada kulit atom paing dalam (dekat dengan inti atom) akan dapat berpindah ke kulit atom yang lebih luar (jauh dari inti atom) bila menyerap energi dari luar atom. Energi tersebut dapat berasal panas pembakaran atau energi listrik yang melewati atom tersebut.
Baca juga : Partikel dalam benda dan mahluk hidup
Semakin jauh letak elektron dari inti atom atau terletak pada kulit atom paling luar, maka elektron tersebut akan mendapatkan gaya tarik yang lemah dari inti atom. Hal tersebut menyebabkan elektron paling luar tersebut mudah lepas dari kulit atom. Elektron yang terdapat di kulit terluar disebut elektron valensi. Lepasnya elektron dari kulit atom tersebut menyebabkan jumlah elektron tidak sama dengan jumlah proton dalam inti atom sehingga menyebabkan atom tersebut menjadi ion atau memiliki muatan listrik.
Teori-teori Atom
Berikut ini beberapa teori-teori yang berkaitan dengan atom.
Teori John Dalton
Berdasarkan teori atom dari John Dalton dapat diketahui bahwa materi terdiri atas atom yang tidak dapat dibagi lagi. Atom digambarkan sebagai bola pejal atau bola tolak peluru yang berukuran sangat kecil. Setiap unsur terdiri atas atom-atom yang identik dan unsur yang berbeda memiliki atom-atom yang berbeda pula.
Gabungan atom akan membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Reaksi kimia merupakan proses penggabungan beberapa atom menjadi sebuah molekul atau proses pemisahan molekul menjadi atom-atom penyusunnya. Oleh karena itu atom tidak dapat diciptakan atau dimusnahkan.
Teori Joseph John Thomson
Atom menurut teori Joseph John Thomson, atom merupakan bola bermuatan positif dan di tempat-tempat tertentu terdapat elektron-elektron yang bermuatan negatif seperti kismis dalam roti. Teori Thomson membantah teori Dalton bahwa atom merupakan bagian yang tidak dapat dibagi lagi.
Teori Ernest Rutherford
Menurut teori atom Ernest Rutherford, atom berbentuk bola yang ditengah-tengahnya terdapat inti atom yang bermuatan positif dan merupakan pusat massa atom, sedangkan elektron bergerak berputar mengelilingi inti atom. Ernest Rutherford membuat model atom seperti tata surya.
Teori Niels Bohr
Menurut teori Niels Bohr, atom terdiri dari inti atom yang menjadi pusat massa atom dan pusat muatan positif, sedangkan elektron bergerak mengelilingi inti atom pada lintasan tertentu (orbit) yang disebut kulit atom. Selama elektron bergerak mengililingi inti atom pada orbitnya, elektron tidak memancarkan atau kehilangan energi.
Baca juga : Memahami Definisi, Muatan, Pembentukan dan Fenomena Listrik Statis serta Elektroskop
Kulit atom yang paling dekat dengan inti atom mempunyai energi yang paling rendah, sedangkan kulit atom yang lebih jauh dari inti atom memiliki energi yang lebih tinggi.
Teori Modern
Menurut teori modern atau mekanika gelombang, atom tersusun atas partikel subatom. Partikel subatom tersebut antara lain neutron (n), proton (p) dan elektron (e).
Neutron dan proton membentuk inti yang padat dan disebut nukleus atau inti atom. Elektron bergerak di sekeliling inti atom membentuk awan elektron yang disebut orbital. Kecepatan elektron bergerak mengelilingi inti atom hampir seperti kecepatan cahaya. Letak elektron pada awan elektron tidak dapat ditentukan.
Contoh Peristiwa Hasil Aktivitas Subatom
Apakah kamu tahu, jika apa yang kamu minum dan makan juga benda yang kamu gunakan dalam kehidupan sehari-hari merupakan hasil dari aktivitas atom dan bagian-bagianya atau subatom? Nah, pada bagian ini, akan dijelaskan contoh peristiwa dalam kehidupan sehari-hari yang ditimbulkan dari aktivitas partikel subatom.
Terbentuknya Molekul
Molekul terbentuk dari susunan dua atau lebih atom yang saling berikatan. Ikatan antara satu atom dengan atom lainnya disebabkan adanya ikatan antar elektron yang terdapat pada kulit terluar. Elektron yang terdapat pada kulit terluar disebut elektron valensi.
Ketika elektron valensi tersebut berikatan maka akan terjadi penggabungan antar atom. Gabungan antar atom tersebut membentuk molekul unsur maupun senyawa dan memiliki wujud atau bentuk tertentu. Jadi aktivitas elektron antar atom dapat menghasilkan suatu molekul yang memiliki wujud dan sifat yang khas.
Baca juga : Memahami Pengertian Energi dan Bentuk Energi Potensial, Kinetik dan Mekanik - IPA MTs
Molekul-molekul hasil dari aktivitas elektron yang merupakan partikel subatom, dapat kamu jumpai dalam kehidupan sehari-hari. Bahkan, kamu juga menggunakan molekul tersebut setiap hari. Berikut ini contoh molekul yang ada di sekitar kamu.
Glukosa
Glukosa termasuk gula sederhana dan merupakan monomer penyusun dari karbohidrat. Kadang glukosa juga disebut dengan gula. Glukosa merupakan senyawa organik yang tersusun dari atom karbon, hidrogen dan oksigen. Rumus molekul C₆H₁₂O₆.
Glukosa merupakan sumber energi bagi tubuhmu yang akan memelihara sel-sel tubuh dan membuatmu dapat beraktivitas. Glukosa dapat kamu jumpai pada nasi yang kamu makan, kentang, singkong, jagung dan lain-lain. Glukosa dihasilkan oleh tumbuhan dengan proses fotosintesis. Jumlah glukosa di bumi sangat melimpah.
Baca juga : Pengertian, bahan, proses, hasil dan manfaat fotosintesis pada tumbuhan
Selain terdapat pada minuman, glukosa juga terdapat pada minuman tapi dengan bentuk lain seperti sakarin. Ketika kamu minum yang manis maka kamu sudah mengkonsumsi glukosa.
Air
Air termasuk molekul senyawa anorganik. Air terbentuk dari ikatan antara atom hidrogen dan oksigen dimana satu atom oksigen berikatan dengan dua atom hidrogen. Rumus molekul air adalah H₂O. Wujud air adalah cairan pada suhu ruang. Pada suhu tinggi akan berbentuk gas dan pada suhu rendah akan berbentuk padat.
Air sangat bermanfaat bagi mahluk hidup. Manfaat air bagi mahluk hidup antara lain : menjaga keseimbangan cairan tubuh, mencegah dehidrasi, berperan dalam metabolisme tubuh, bahan fotosintesis pada tumbuhan dan lain sebagainya.
Baca juga : Penyebab banjir dan solusinya
Sebaiknya kamu mengkonsumsi air setiap hari minimal sebanyak 30 cc tiap kilogram dari bobot tubuhmu. Jika bobotmu 50 kg, kamu sebaiknya mengkonsumsi air sebanyak 1500 cc atau sekitar 1,5 liter.
Oksigen
Oksigen termasuk ke dalam molekul unsur. Oksigen merupakan ikatan antar dua atom O dan berwujud gas. Rumus molekul oksigen adalah O₂. Oksigen tidak dapat kamu lihat, tetapi dapat kamu rasakan. Oksigen berasal dari hasil fotosintesis tumbuhan. Jumlah oksigen di udara sekitar 20,93%.
Oksigen dalam tubuh mahluk hidup berperan dalam pembakaran glukosa yang akan menghasilkan energi. Pada manusia oksigen diperoleh melalui organ pernafasan kemudian akan diikat oleh sel darah merah dan diedarkan ke seluruh sel-sel tubuh.
Oksigen di udara akan membentuk ozon ketika terkena paparan sinar ultraviolet. Ozon tersebut akan melindungi mahluk di bumi dari radiasi sinar ultraviolet tersebut yang dapat mengakibatkan gangguan kulit.
Berdasarkan hal tersebut, oksigen memiliki fungsi yang amat penting bagi keberlangsungan hidup mahluk di bumi. Tanpa oksigen, mahluk di bumi akan mengalami kepunahan. Jadi, mari bersama-sama menjaga oksigen di bumi dengan menjaga dan merawat serta menanam pohon karena pohon merupakan sumber penghasil oksigen. Save the tree.
Karbondioksida
Karbondioksida merupakan molekul senyawa anorganik. Karbondioksida disusun oleh ikatan karbon yang mengikat dua atom oksigen. Rumus molekul dari karbondioksida adalah CO₂.
Karbondioksida dihasil oleh pembakaran yang sempurna. Bagi manusia dan hewan, karbondioksida membahayakan tubuh jika terjadi penumpukan salah satunya yaitu membuat tubuhmu lemas. Bila terjadi penumpukan karbondioksida di udara akan mengakibatkan peningkatan suhu permukaan bumi dan permasalah iklim. Permasalahan tersebut disebut dengan efek rumah kaca.
Bagi tumbuhan, karbondioksida sangat dibutuhkan karena diperlukan sebagai bahan pembentukan glukosa dan oksigen. Glukosa dan oksigen tersebut merupakan komponen yang sangat dibutuhkan oleh manusia dan hewan. Jadi, tumbuhan dapat berperan sebagai organisme pendaur ulang karbondioksida.
Alkohol
Alkohol merupakan molekul senyawa organik yang memiliki gugus hidroksil (-OH) dimana gugus hidroksil tersebut terikat pada atom karbon.
Alkohol diperoleh dari proses fermentasi yang dilakukan oleh bakteri. Pembuatan makanan dan minuman melalui fermentasi memberikan bau dan cita rasa sendiri seperti makanan dan minuman hasil bioteknologi konvensional. Konsentrasi alkohol yang tinggi dapat digunakan sebagai antiseptik atau sebagai pembunuh bakteri.
Baca juga : Produk bioteknologi konvensional
Contoh-contoh di atas adalah sedikit dari banyak molekul yang ada di kehidupan sehari-hari. Coba kamu cari tahu contoh-contoh lainnya dari molekul yang kamu gunakan sehari-hari.
Terbentuknya Cahaya Lampu
Perhatikan warna lampu di bawah yang mana tiap lampu mengandung gas mulia helium (He), neon (Ne), argon (Ar), kripton (Kr) dan xenon (Xe).
 |
| Warna cahaya lampu dengan kandungan gas berbeda |
Lampu-lampu tersebut mengeluarkan cahaya yang berwarna-warni setelah dialiri arus listrik. Cahaya yang berwarna-warni tersebut muncul dikarenakan oleh adanya loncatan elektron yang terdapat di dalam atom-atom gas. Loncatan elektron tersebut terjadi karena atom-atom gas mendapat energi dari listrik
Terbentuknya Cahaya pada Kembang Api
Kamu mungkin pernah melihat kembang api yang meledak di udara kemudian menghasilkan cahaya yang berwarna-warni. Cahaya warna-warni dari kembang api yang meledak di udara ditimbulkan kerena terbakarnya bahan kimia yang terdapat di dalam kembang api. Bahan kimia yang terdapat pada kembang api antara lain :
- alumunium yang akan menghasilkan warna putih dan berkerlip
- barium yang akan menghasilkan warna hijau
- garam kalsium yang akan menghasilkan warna orange
- magnesium yang akan menghasilkan warna putih terang
- tembaga yang akan menghasilkan warna biru
- natrium yang akan menghasilkan warna kuning
- besi yang akan menghasilkan kilatan cahaya dan lain-lain
Ketika kembang api dibakar akan membuat temperatur (suhu) unsur-unsur penyusun kembang api semakin tinggi sehingga menyebabkan elektron dari kulit terluar atom satu ke kulit terluar atom lain. Perpindahan elektron ini disertai dengan cahaya dengan warna tertentu dari unsur-unsur penyusunnya.
Baca juga : Memahami Sumber Energi Tak Terbarukan dan Terbarukan - IPA MTs
Peristiwa-peristiwa lainnya yang merupakan aktivitas elektron antara lain kilatan cahaya petir yang disebabkan oleh loncatan elektron-elektron dari awan bermuatan negatif ke bumi yang bermuatan positif atau juga loncatan elektron-elektron dari satu awan ke awan lainnya.
Pemanfaatan Subatom Elektron
Seiring perkembangan pengetahuan mengenai partikel elektron dari suatu atom, kemudian manusia memanfaatkannya untuk membuat suatu teknologi yang berguna bagi manusia dalam mengembangkan pengetahuan maupun kesehatan. Pada bagian ini akan memberikan informasi mengenai teknologi yang memanfaatkan elektron.
Mikroskop Elektron
Mikroskop adalah alat yang dapat digunakan untuk melihat benda yang berukuran sangat kecil, seperti virus dan organel sel. Mikroskop yang banyak dikenal adalah mikroskop cahaya. Melalui pengetahuan mengenai elektron, manusia menciptakan mikroskop elektron. Mikroskop elektron dapat melakukan perbesaran dari 1000 sampai 1 juta kali.
Mikroskop elektron menggunakan berkas elektron sebagai pengganti cahaya. Kemampuan perbesaran mikroskop elektron diakibatkan oleh panjang gelombang elektron yang pendek. Panjang gelombang elektron sekitar 100 ribu kali lebih kecil dari panjang gelombang cahaya tampak. Panjang gelombang yang pendek dari elektron mengakibatkan gambar dari mikroskop elektron berupa gambar hitam dan putih. Tetapi itu dapat diatasi dengan pemberian warna secara buatan untuk menekankan suatu bagian.
Pada mikroskop elektron tidak digunakan lensa kaca, melainkan menggunakan lensa elektromagnetik untuk memfokuskan berkas elektron pada objek yang diamati.
Sinar X atau Sinar Roentgen
Sinar X biasa digunakan untuk mendiagnosis atau menganalisis penyakit atau gangguan organ dalam seperti patah tulang dan paru-paru. Sinar X pertama kali ditemukan oleh Wilhelm C Roentgen pada tahun 1895. Dia menemukan bahwa ketika elektron yang memiliki energi tinggi menabrak suatu material seperti gelas, maka material tersebut akan memancarkan radiasi yang dapat menembus benda yang tidak dapat ditembus cahaya biasa. Radiasi merupakan energi yang dialirkan dalam bentuk gelombang elektromagnet atau partikel subatom. Radiasi tersebut diberi nama sinar X.
Baca juga : Memahami Definisi Cahaya dan Sifatnya - IPA MTs
Jadi sinar X merupakan radiasi elektromagnetik yang memiliki panjang gelombang pendek sekitar 10⁻¹⁰ m dan dihasilkan dari elektron-elektron yang tereksitasi dalam atom kemudian meloncat dari satu kulit atom luar ke kulit atom lebih dalam. Roentgen juga menunjukkan bahwa sinar X dapat membuat plat film dan menghasilkan gambar dari objek yang tidak tembus pandang.
Selain untuk mendiagnosis penyakit, sinar X juga dimanfaatkan untuk menganalisis struktur molekul suatu senyawa yang berbentuk kristal. Teknik ini dikenal dengan kristalografi.
Penutup
Sekian informasi yang dapat kami berikan mengenai partikel subatom dan teori atom. Mudah-mudahan bermanfaat menambah pengetahuan bagi yang membaca artikel ini. Silahkan bagikan artikel ini kepada teman-temanmu agar mereka juga mendapatkan manfaat yang sama. Berbagilah yang baik dan bermanfaat.
Bagikan artikel :
